Neues Osteoporose-Medikament ante portas: Kommt der Sklerostin-Antikörper Romosozumab auch bei uns?
Bochum, 22. Januar 2019:
Am 8. Januar wurde in Japan als erstem Land Romosozumab für die
Osteoporosetherapie zugelassen. Im DGE-Blog wurde erstmals im Jahre
2012 (1) und in den folgenden Jahren mehrfach über diese Substanz der
Firmen AMGEN und UCB berichtet. Es handelt sich um einen gegen
Sklerostin gerichteten humanisierten monoklonalen Antikörper. Sklerostin
ist ein von den Knochenzellen sezerniertes Protein, welches die
Knochenneubildung hemmt, sein dagegen gerichteter Antikörper Romosozumab
wirkt somit osteoanabol. Dies erkennt man am Anstieg des
Prokollagen-1-N-terminalen Peptids (P1NP), eines Markers des
Knochenanbaus. In der FRAME-Studie (2) bei postmenopausalen Frauen bewirkte im 1. Jahr die 1x monatliche s.c. Gabe von Romosozumab gegenüber Plazebo einen Rückgang der Wirbelkörperfrakturen. Nach dem ersten Jahr wurde
das Antiresorptivum Denusomab (Prolia®) gegeben und nach zwei Jahren
waren die Wirbelkörperfrakturen um 75% vermindert. Als ernste
Nebenwirkungen war es unter Verum zu zwei Kiefernekrosen und einem
atypischen Oberschenkelbruch gekommen. In einer Head-to Head-Studie von
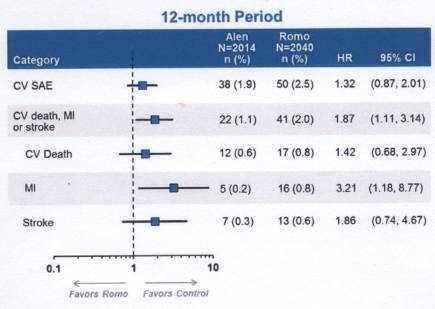
Romosozumab vs. Alendronat (ARCH-Studie)
zeigte sich, ebenfalls an postmenopausalen Frauen, auch ein günstiger
Knocheneffekt. Hier kam es in der Romosozumab-Gruppe jedoch häufiger zu
ernsten kardialen und zerebrovaskulären (CV) Ereignissen (3) . Diese
waren auch in der BRIDGE-Studie an männlichen Osteoporosepatienten häufiger. Da sich Sklerostin außer im Knochen
auch im Aortengewebe und hochreguliert bei Gefäßverkalkungen und in
Herzklappen findet, könnte Sklerostin ein negativer Regulator für
Gefäßverkalkungen sein. Ob dies die potentiellen ernsten CV
Nebenwirkungen von Romosozumab erklären könnte, ist offen. Die CV
Sicherheitsdaten lagen der FDA beim ersten Zulassungsantrag im Mai 2017 nicht vor, er wurde daher zurückgestellt (4).
Zulassungsstatus:
Japan (PMDA): Am 8. Januar 2019 wurde Romosozumab mir dem Handelsnamen Evenity in Japan approbiert.
FDA: Vor wenigen Tagen votierte das
FDA-Beratergremium mit 18:1 Stimmen (mit gewissen Vorbehalten einiger
Mitglieder) für die Zulassung dieses knochenanabolen
Osteoporosemedikaments, mit der von AMGEN vorgeschlagenen
Indikationsstellung: Osteoporosebehandlung postmenopausaler Frauen mit
hohem Frakturrisiko, definiert als: Vorgeschichte mit osteoporotischen
Knochenbrüchen, multiple Risikofaktoren für Brüche, oder ungenügende
Wirkung oder Unverträglichkeit anderer Osteoporose-Medikamente. Eine Box
im Beipackzettel soll eine Warnung für Patienten enthalten, die schon
einmal Herzattacken oder einen Schlaganfall hatten. Im zweiten Zulassungsantrag an die FDA vom 16.1.2019 steht: „A
meta-analysis of time to first MACE using data from all three phase 3
trials, found a HR of 1.40 (95% CI: 0.99-1.99) for the comparison of
rosomozumab to placebo and alendronate combined”. Es wurde ein möglicher CV Schutzeffekt von Alendronat diskutiert (Daten der ARCH-Studie im 1. Jahr auf der Abbildung unten).